根据中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院《关于修改〈医疗器械监督管理条例〉的决定》,国家药品监督管理局医疗器械临床试验机构由资质认定改为备案管理。为此,原国家食品药品监督管理总局会同国家卫生和计划生育委员会制定了《医疗器械临床试验机构条件和备案管理办法》,明确规定自2019年1月1日起,医疗器械(包括体外诊断试剂)临床试验必须在已经备案的机构开展临床试验。
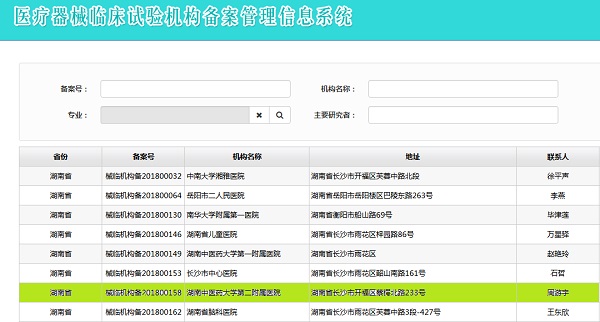
我院于2018年2月启动了医疗器械临床试验机构备案工作,临床试验办公室经过几个月的备案材料准备、数据录入和提交审核,7月6日,我院通过了医疗器械临床试验机构备案,成为全国第158家,我省第7家通过备案的机构,标志着我院又新增了一个国家级科研平台——国家医疗器械临床试验机构,同时,具备了开展相关医疗器械和体外诊断试剂创新产品的临床试验工作的资质。本次共备案了来自17个科室的40个专业,26位主要研究者。
此次备案的专业范围,包括呼吸内科、消化内科、心血管内科、肾病、内分泌、医学检验、病理、医学影像科、预防保健科、神经内科、神经外科、普通外科、泌尿外科、重症监护室和中医内科、中医外科、中医妇产、中医儿科、中医皮肤、中医眼科、中医耳鼻喉、中医口腔、中医肿瘤科、中医骨伤、中医肛肠、中医老年病、中医针灸、中医康复、中医急诊、中医预防保健、护理专业等,涵盖了我院的全部医疗和技术科室。医疗器械的类别,包括手术器械、物理治疗器械、无源植入器械、口腔科器械、医用软件、医用成像器械、输血透析和体外循环器械、注输护理和防护器械、辅助生殖和避孕器械、检验器械、神经和心血管手术器械、医用诊察和监护器械、消毒灭菌器械、承载器械、康复器械、体外诊断试剂、骨科手术器械、呼吸麻醉和急救器械、眼科器械、中医器械等。从2019年1月1日起,我院涉及上述专业的临床医技科室的26名主要研究者,已经分别具备(牵头)进行上述类别医疗器械临床试验工作资格。
通过备案登记后,我院将可以承担相关医疗器械和体外诊断试剂创新产品的临床试验工作。我院有着多年的药物及医疗器械临床试验管理经验,具备高水平的专业技术能力、质量管理能力和伦理审查能力,此次医疗器械临床试验机构的备案,使我院临床试验工作更上了一个台阶,临床研究水平也将得到进一步提升。
作者:向黎黎



![]() 湘公网安备 43010502001159号
湘公网安备 43010502001159号
